|
|
Órgão Oficial de Divulgação Científica da
|
ISSN: 1679-1796
|
Tumor Estromal Gastrointestinal
Gastrointestinal Stromal Tumor
Rosalia Mariko Yokoyama, Ronaldo Nonose, Juliano Fernandes Costa, Juliana Santos Valenciano
Trabalho realizado no Hospital Intersaúde de Santo André.
Os tumores estromais são tumores de origem não epitelial da camada muscular da parede gastrointestinal.
É diagnosticado através de imunohistoquímica quando há expressão do c-kit 117. Os locais de ocorrência são
por freqüência: estômago, cólon, reto e esôfago. Acomete mais indivíduos da quinta década de vida e são considerados tumores raros
do trato gastrointestinal. O presente estudo tem como objetivo realizar um relato de caso e uma revisão bibliográfica sobre a
doença, critérios diagnósticos e tratamento do GIST.
Palavras-chave: Tumor Estromal Gastrointestinal, GIST.
Gastrointestinal stromal tumor (GIST) is the designation for the specific c-kit expressing and kit-signaling
driven mesenchymal tumors. GISTs are the most common mesenchymal tumors of the gastrointestinal tract. They
are defined here as KIT CD117, steam cellor epitelioid neoplasms primary in the gastrointestinal tract, omentum,
and mesentery. GISTs typically present in older individuals and are most common in the stomach, followed by small intestine, colon
and rectum, and esophagus. Older adults are more risk for GIST. The propose of this study is report a case and review the
disease, diagnosis criteria and treatment of the GIST.
Key words: Gastrointestinal Stromal Tumor, GIST.
|
Yokoyama R.M., Nonose R., Costa J.F., Valenciano J.S. Tumor Estromal Gastrointestinal. Rev bras videocir 2007;5(2):65-71. |
||
|
Recebido em 17/06/2007 |
|
Aceito em 13/07/2007 |
s tumores estromais do trato gastrointestinal são também denominados
de GIST (Gastrointestinal stromal tumor).
A origem desses tumores indiferenciados pode estar na célula intersticial de Cajal,
conhecida como o marca-passo intestinal do plexo
mioentérico, responsável pela motilidade
gastrointestinal1. Podem ter origem na proliferação imatura das
células epitelióides ou fusiformes a partir da
camada muscular da parede gastrointestinal.
Inicialmente a classificação de
tumor estromal englobava os tumores de origem no
tecido muscular do trato digestório, leiomiomas
e leiomiossarcomas; os de origem no tecido nervoso do plexo mioentérico, denominados schwanomas
e tumor autonômico do nervo gastrointestinal e os
de origem indeterminada, classificados como indiferenciados
2.
Estudos recentes mostram que apenas uma parte desses tumores é originária de
diferenciação das células de origem muscular, sendo provável
que a maioria se origine a partir de células
mesenquimais primitivas, relativamente indiferenciadas,
com capacidade limitada ou imperfeita para diferenciação miogênica
2,3,4.
A diferenciação entre tumores com
padrão de células de bainha nervosa ou de padrão
muscular é difícil apenas pelo aspecto microscópico
convencional, sendo muitas vezes necessária
análise imunohistoquímica e ultraestrutural do tumor
para melhor definição. Podem se apresentar como
células fusiformes com moderadas a abundantes
quantidades de citoplasma e núcleo alongado, característicos
de células musculares lisas ou com predomínio de
células epitelióides de padrão diferenciado
5.
O tumor estromal deve ser sempre considerado como maligno na ocasião do seu
diagnóstico, pois entre 10 a 30% dos casos já se apresentam
como doença avançada com metástase à distância
ou doença irressecável. Apesar disso, entre 70 a
90% existe um potencial de malignidade
incerto 6.
Atualmente, os tumores estromais são classificados de acordo com seu padrão
histoquímico e não mais pelo aspecto histológico, sendo
obrigatória a presença de determinados marcadores para
se classificar o tumor como estromal. No entanto o potencial de agressividade do tumor é definido
pelas suas características
histológicas 6,7.
O presente estudo tem como objetivo descrever um caso e realizar uma revisão
bibliográfica sobre a doença, critérios diagnósticos
e tratamento.
Relato de caso
Paciente de 48 anos, do sexo feminino, cor branca e queixa principal de "dor no estômago"
há 5 anos. Esta dor epigástrica era do tipo
queimação melhorando com a alimentação ou uso de
antiácido. Referia ainda empachamento, embora
negasse alteração de apetite, náusea ou vômitos.
Ritmo intestinal normal, sem perda de peso ou anemia.
De antecedente sintomatológico era portadora
de hipertensão arterial.
Durante a investigação diagnóstica,
foi solicitado endoscopia digestiva alta que evidenciou gastrite e lesão de 2 cm em
submucosa do antro gástrico, sugestivo de leiomioma,
porém, não foi realizado biópsia da lesão por
dificuldade técnica.
Submetida a uma ultra-sonografia endoscópica, na qual foi identificada uma lesão
de submucosa, na face anterior do corpo distal,
medindo 2,7x1,5cm, hipoecogênica, homogênea,
ovalada, bem delimitada e localizada na muscular
própria. Foi realizado punção para citologia e
imunohistoquímica.
A citologia do aspirado identificou
células fusiformes e a imunohistoquímica
apresentou positividade para C-kit, CD 34 e negativo
para Proteína S-100.
Realizada nova endoscopia digestiva, que revelou uma lesão nodular arredondada
em submucosa de antro, com 2,5 cm de
diâmetro, recoberta por mucosa normal Desta feita a
biópsia foi sugestiva de GIST. Reação à urease negativa.
Pela ausência de invasão ou metástases
foi indicada ressecção cirúrgica através da
videolaparoscopia, com ressecção em cunha da lesão
e grampeamento, com três cargas azuis de
cirurgia bariátrica.
No anátomo-patológico, foi
diagnosticado GIST com margem de ressecção livres.
Atualmente, a paciente encontra-se em
acompanhamento ambulatorial.
Características Clínicas
Os tumores estromais são de ocorrência
rara, correspondendo a apenas 1 a 4% dos tumores
do trato digestório 6.
Acometem mais frequentemente pessoas entre a quinta e sexta década de vida, mas
também acometem indivíduos jovens em proporção maior
que a observada nos tumores epiteliais, que tem predomínio na meia idade. A prevalência
desses tumores em crianças é muito rara
8,9.
Na maior parte das vezes podem se apresentar de forma assintomática.
Os sintomas mais comuns encontrados são dor abdominal e sangramento, podendo se
observar também massa abdominal palpável,
emagrecimento e astenia como sintomas freqüentes em tumores
de maior tamanho. GUY em 2003 realizou um estudo com 116 pacientes com GIST e verificou que
havia variação do tamanho do tumor que variou de 13
a +6 cm 10.
Pode-se observar a ocorrência do tumor em qualquer segmento do trato digestório onde
haja camada muscular, considerando-se todos os componentes da camada muscular, incluindo
tecido muscular liso, tecido nervoso originário do
plexo miontérico ou de células mesenquimais
primitivas, do esôfago ao reto, com distribuição não
uniforme nos diversos segmentos.
A grande maioria dos casos de GIST ocorre no estômago (60-70%), intestino delgado
(25-30%), com ocorrência rara em cólon e reto (5%),
esôfago e apêndice cecal (2%)
6,11.
Outro ponto que deve ser considerado em casos de GISTs é a relação existente entre
a localização do tumor e o potencial de malignidade.
Na distribuição topográfica dos
tumores estromais, o sítio de localização mais freqüente
no estômago é o terço médio, seguido do terço
proximal e menos frequentemente no terço distal.
Observaram-se ainda pacientes com mais de um
sítio primário de lesão, e há relato de um caso com
14 sítios primários de lesão no estômago
9.
A localização dos tumores estromais
no intestino delgado ocorre de forma uniforme ao
longo de toda sua extensão, sem segmento
preferencial, podendo representar até 20% dos tumores
malignos nesse segmento9.
Os tumores estromais são raros em cólon
e reto, devido a grande quantidade de tecido muscular nesse segmento do trato
gastrointestinal, sendo responsáveis por 0,1% a 0,3% dos
tumores malignos colorretais8.
O comportamento dos tumores estromais nessa região varia de acordo com o
segmento acometido, sendo que os tumores de cólon são
menos agressivos, com melhores resultados após
o tratamento cirúrgico, enquanto que os tumores
do reto disseminam para a pelve apresentando altos índices de recidiva local mesmo após
ressecções amplas com intenção
curativa12.
É referido por diversos autores que
GISTs de esôfago, além de serem raros são também
pouco agressivos, ao passo que tumores estromais gastrointestinais c-KIT positivos situados
no intestino delgado geralmente apresentam
potencial maligno bem mais evidente11.
A disseminação dos tumores estromais
ocorre pela invasão de órgãos adjacentes e por
via hematogênica. Frequentemente acometem o
fígado, o pulmão e o peritônio. Há relatos da presença
de metástases em até 87% dos casos de GIST
6. As metástases linfonodais são raras, e quando
ocorrem reduzem o período de sobrevivência. Dessa
forma, deve se levar em conta além da celularidade e
do volume tumoral, a localização dos GISTs também
é importante para a decisão de condutas.
Diagnóstico
O diagnóstico dos tumores estromais do
trato digestório é determinado por estudo histológico
e imunohistoquimico através de biópsias das lesões
ou do estudo das peças resultantes de
ressecção cirúrgica, muitas vezes realizada sem um
diagnóstico pré-operatório pela dificuldade na obtenção
de biópsias dos tumores, na maior parte das
vezes localizados em plano submucoso.
A análise imunohistoquímica com estudos
de marcadores específicos se faz necessário para
sua diferenciação com outros tumores do trato digestório.
O c-Kit, também denominado CD117, é
um marcador utilizado no diagnóstico do tumor
estromal do trato digestório e caracteriza-se por ser
um receptor de membrana celular, classificado como fator regulador do crescimento celular ou
fator formador de colônia, essencial no
desenvolvimento de melanócitos, eritrócitos, mastócitos,
células germinativas e da célula intersticial de Cajal
6.
Todos os tumores estromais são
considerados malignos 6.
O CD117 está presente em até 94%
dos tumores estromais gastrointestinais e é o
marcador mais importante no diagnóstico de GIST.
Segundo a maior parte dos autores, só pode ser
considerado tumor estromal aquele que tem expressão
CD117 em sua superfície 3,5,13.
Outros critérios diagnósticos
incluem positividade para CD34 em 70% e proteína S100
em 10% .
O prognóstico dos tumores estromais pode
ser estabelecido através de sua caracterização
histopatológica, com diversas variáveis que devem
ser analisadas para se determinar o grau de
malignidade da lesão. Dentre as quais podemos citar as
principais: número de figuras de mitose por campo, tamanho
do tumor, necrose tumoral e porcentagem de
células epitelióides em relação às fusiformes.
A agressividade do tumor estromal gastrointestinal está intimamente relacionada ao
tamanho da lesão, demonstrando-se que os tumores
maiores que 5 cm de extensão têm prognóstico
reservado, enquanto as lesões menores que 5 cm
apresentam melhor evolução, com melhores índices de
sobrevida em 5 anos1.
O número de figuras de mitose por campo parece está também associado ao grau de
agressividade do tumor, com relação direta entre o
número de mitoses por campo e o grau de malignidade.
Os tumores com contagem maior que 5 mitoses / 10 campos de maior aumento
são consideradas de comportamento maligno,
contagem entre 2 a 5 mitoses / 10 campos de maior
aumento, como potencialmente malignos e lesões com
menos de 2 mitoses / 10 campos tem comportamento
benigno.1
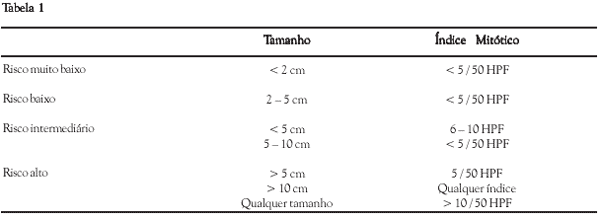
FLETCHER e cols, em 2003, elaboraram o risco de malignidade do tumor estromal
baseando-se no tamanho da lesão em relação ao número
de mitoses por campo microscópico em grande
aumento, que serve como diretriz para as condutas
relacionadas ao tumor estromal, como mostra a Tabela-1.
 |
A análise ultra-estrutural dos tumores consiste na pesquisa de proteínas e
marcadores específicos presentes nas células tumorais e
na avaliação da estrutura das células, que podem
ser típicas de tecido muscular e ou nervoso, e permite
a diferenciação entre tumores provenientes de
células musculares lisas e os de origem nervosa.
A presença de segmentos musculares com filamentos de actina nos cortes histológicos
dos tumores permite identificar as lesões de
origem muscular, com configuração típica dos
tecidos musculares lisos. Nas lesões originárias dos
plexos mioentéricos esta configuração não é observada.
Nos tumores com características
tipicamente de origem nervosa a histologia é característica,
com células apresentando núcleos com grânulos
densos e configuração própria das células de
origem nervosa.
Nesses tumores, em que até a
caracterização da origem da lesão é difícil apenas por seu
aspecto, não é possível determinar se a lesão é de
origem epitelial ou mesenquimal. Neste caso torna-se
de extrema importância a pesquisa de
marcadores específicos para a identificação precisa de
sua orígem.
A proteína S100 é um marcador típico
das lesões originárias do plexo mioentérico,
estando presente na maior parte dos tumores de
origem nervosa e ausente nos de origem muscular ou
nos tumores estromais de origem não definida.
O antígeno denominado CD34 é uma glicoproteina de superfícies celular,
originalmente descrita como um grupo de anticorpos
monoclonais presentes em células precursoras de
tecido mielóide e linfóide na medula óssea. Desde a
sua identificação, o CD34 foi detectado em
diversos tecidos normais, incluindo endotélio
vascular, células precursoras de medula óssea e alguns
tipos de células fibroblásticas da derme. Este
antígeno pode ser detectado em tipos de tumores,
como angiossarcoma, sarcoma epitelióide e sarcoma
de Kaposi14.
Como o CD34 raramente se expressa nos tumores de origem epitelial, sua identificação
pode ser útil no diagnóstico diferencial dos
tumores estromais, especialmente nos de aspecto
epitelióide, em que sua diferenciação apenas pelo
aspecto histológico e ultra-estrutural muitas vezes não
é possível e o CD34 se expressa de maneira
significativa nesses tumores14.
Aproximadamente 20% a 30% dos tumores estromais expressando o CD 117 também
apresentam positivada à actina, e considerando-se a
presença dos dois marcadores ao mesmo tempo, podemos
inferir que a origem dessas lesões pode ter mais de um
sitio primário, muscular e nas células de Cajal,
por exemplo.
A biologia molecular dos tumores estromais pode ser útil na avaliação do prognóstico das
lesões. O gene p53 é um gene supressor de tumor, que
atua sobre o ciclo celular bloqueando a transição
entre as fases G1 e S da replicação celular. Em
alguns tumores, pode ocorrer a deleção ou mutação
desse gene 9,11. A perda de função do p53 leva a
uma alteração na sua ação sobre a proliferação celular,
e o p53 passa a agir como um oncogene.
A expressão do gene p53 indica proliferação celular indiscriminada, estando
associada ao pior prognóstico das lesões,
observada nos tumores mais agressivos, nos quais o p53
se manifesta de maneira significativamente aumentada, podendo, portanto ser relacionado
aos tumores malignos, e consequentemente ao prognóstico dessas
lesões9.
O KI-67 é um antígeno marcador de proliferação celular, e está presente nos tumores
em que há intensa proliferação celular, podendo
também estar relacionado a um pior prognóstico.
<
Tratamento
Ao estabelecer o diagnóstico de GIST,
deve-se proceder a um rigoroso estadiamento com finalidade de analisar a extensão da doença e
assim auxiliar na proposição terapêutica a ser adotada.
O tratamento dos tumores estromais é preferencialmente cirúrgico e a unanimidade
dos autores considera o tratamento operatório a
melhor opção terapêutica quando se tem por objetivo a
cura do doente, preconizando-se a ressecção do tumor
e órgãos adjacentes quando acometidos
1,15.
A principal indicação de ressecção
tumoral é representada pelas neoplasias primárias,
sem metástases e com possibilidade de serem
totalmente ressecáveis.
Quando indicada a exérese do tumor, devem-se considerar outros fatores, como
a localização do GIST, seu potencial maligno, o
tipo de ressecção necessária para sua remoção e
as condições clínicas do doente.
Como esse tumor pode se originar em qualquer segmento do tubo digestivo é
importante reconhecer que o risco operatório assim como
o potencial de malignidade está relacionado ao
órgão acometido pela neoplasia.
De forma geral, em diferentes tipos de tumores malignos (adenocarcinomas, linfomas
etc.) as operações necessárias para tratamento
quando praticadas sobre o esôfago, cólon e reto diferem
em seus resultados daqueles observados em procedimentos que envolvem o estômago,
intestino delgado e peritônio.
Da mesma forma polipectomias, exérese de pequenos segmentos do trato digestivo,
geralmente estão associadas a menores índices de
complicações e mortalidade do que os observados em
ressecções mais extensas.
A radicalidade cirúrgica é a meta a
ser alcançada objetivando cura de neoplasias, porém,
o risco de operações maiores deve sofrer
criteriosa avaliação, especialmente para casos de GISTs,
pois, apesar de alguns desses tumores terem alto
potencial de malignidade, outros considerados como
menos agressivos evoluem para malignidade de forma bastante indolente. Esse aspecto relacionado
à natureza do GIST deve ser efetivamente
considerado na indicação operatória especialmente em casos
de alto risco cirúrgico.
Em caso de ressecção visando cura,
alguns preceitos devem ser observados tais como a
remoção total da neoplasia evitando contaminação
tumoral. Para tanto, a manipulação deve ser mínima e
com medidas que protejam os tecidos e estruturas
que circundam o tumor. Deve-se evitar ruptura da neoplasia, pois, nesses casos, a implantação
de células neoplásicas é comum.
A margem livre de 4,0 cm, avaliada macroscopicamente, é suficiente, pois os GISTs
têm pequena capacidade de infiltrar a parede da
víscera através de suas túnicas. As margens livres
de neoplasia não necessitam ser
extensas1,6,15.
Na presença de órgãos ou
estruturas adjacentes ao tumor invadidas ou aderidas
a neoplasias deve ser removida em monobloco. As metástases linfonodais ocorrem raramente
nesses tumores, não havendo necessidade de
linfadenectomia sistemática.
Na suspeita clínica de GIST operados em caráter de urgência particularmente por
obstrução ou hemorragia, devem ser obedecidos os
mesmos critérios referidos anteriormente, mas tendo
como principal objetivo o tratamento do quadro
agudo. Nesses casos, sempre que possível, realizar
a linfadenectomia sistemática, pois o diagnóstico
final de GIST só será definido após estudo
imunohistoquímico7.
Alguns autores indicam a exerese tumoral de GISTs primários passíveis de ressecção,
mesmo que em sua apresentação inicial possuam
metástases. Além da neoplasia primária, devem ser ressecadas
a totalidade ou o maior número de metástases
possível e, nesses casos, a complementação com outras
formas de tratamento tem sido comumente empregada
6,11.
O tratamento será conservador quando ocorrer recidiva da neoplasia após
tratamento operatório prévio ou quando exista
irressecabilidade tumoral identificada através de
exames clínicos, propedêuticos no ato operatório ou,
ainda, quando constatadas metástases em
diferentes órgãos tais como fígado, pulmão, peritônio e
outros locais16.
A resposta à quimioterapia convencional, radioterapia e terapias adjuvantes não se
mostram satisfatórias. Não se obteve alterações nos índices
de sobrevida ou nas taxas de recorrência, recidiva
local ou metastática. As respostas foram menores que
10% na quimioterapia e menos de 5% na radioterapia.
O mesilato de imatinib é uma alternativa no tratamento quimioterápico dos tumores
estromais. É um inibidor seletivo das tirosinoquinases,
entre elas o CD117 que é específico desse grupo
de tumores. É necessário que haja presença
do marcador CD117, pois o mesilato de imatinib se
liga aos receptores tirosinoquinase presentes na membrana das células tumorais, inibindo
seu crescimento. Devido ao seu mecanismo de ação,
não age sobre tumores que não expressam o
marcador em sua superfície17.
O mesilato de imatinib é conhecido com o nome comercial de "Glivec", sendo
administrado por via oral em doses que variam de 400 e 800
mg/dia. Os resultados preliminares com emprego
dessa substância, em diferentes trabalhos, mostraram
que 45 a 75% dos doentes apresentam resposta
parcial ou doença estável.
A indicação do mesilato de imatinib
é restrita para casos de doença considerada
irressecável, em lesões recidivadas sem possibilidade
de ressecção cirúrgica ou com metástase à
distância, pois se manifesta com toxicidade importante.
Apresenta 80% de resposta parcial ou doença estável.
A incidência de efeitos colaterais com o
uso da droga é alta, sendo que os mais comuns
são hemorragia, neutropenia, rash cutâneo,
alterações das provas de função hepática, anemia, diarréia
e cefaléia. A hemorragia pode ocorrer no interior
do tumor, sendo o efeito colateral mais grave
observado com o uso da medicação
1,3.
Podemos concluir que a cirurgia ainda é
o tratamento de escolha para o tumor estromal gastrointestinal.
Referências Bibliográficas
1. Fletcher C.D.; Berman J.J; et al. "Diagnosis
of gastrointestinal stromal tumors: A consensus
approach". Hum Patlol. 2003;34(5):512-3.
2. Miettinen M.;Virolainen,M;et
al."Gastrointestinal stromal tumors-value of CD34 antigen in
their identification and separation from true leiomyomas
and schwanomas". Am J Surg Pathol 1995;19(2):207-16.
3. Miettinen M.;Majidi M; Lasota J.;
"Gastrointestinal stromal tumors - definition, clinical,
histological, immunohistochemical, and molecular genetic
features and differential diagnosis". Virchows
Archiv 2001;438(1):1-12.
4. Shiu,M.H.;Farr,G.H.; et al "Myosarcomas of the
stomach: Natural history, progmnostic factors and
management" Br J Surg 1997;84:560-1.
5. Wieczorek T.;Faquin W.; et al. "Cytologic diagnosis
of gastrointestinal stromal tumor with emphasis on
the differential diagnosis with leiomyosarcoma".
Cancer Cytopathology 2001;93(4):276-87.
6. Miettinen M.;Majidi M; Lasota J.; "Pathology
and diagnostic criteria of gastrointestinal stromal
tumors (GISTs): a review". Eur J Cancer 2002;38(5):S39-51.
7. Sandrasegaran K.; Rajesh A.; et al.
"Gastrointestinal stromal tumors: clinical, radiologic, and
pathologic features". Am J Roentgenol 2005;184(3):803-11.
8. De Matteo RP, Lewis JJ, Leong D et al. "Two
hundred gastrointestinal tumor. Recorrence patterns and
prognostic factors for survival". Am Surg 2001;231:12-27.
9. Emory TS, Sobin LH, Lukes L et al. "Prognosis
of gastrointestinal smooth muscle (stromal)
tumors: dependency on anatomic site". Am J Suge Pathol
1999; 23:83-87.
10. Guy JA, Picand R, Giuly D et al. "malignant
gastrointestinal stromal tumor: distribution,
imaging features, and pattern of metastatic spread". Am J
Surg 2003;185: 86-7.
11. Burkill G.J.C.; Badran M; et al.
"Malignant gastrointestinal stromal tumor: distribution,
imaging features, and pattern of metastatic spread".
Radiology 2003;226:527-32.
12. DeMatteo RP, Heinrich MM, Rifai W.
"Clinical management of gastrointestinal stromal tumor:
before and after STI-571". Hum Pathol 2002;33:466-77.
13. Suster S.; Sorace D.; et al. "Gastrointestinal stromal
tumors with prominent myxoid matrix.
Clinicopathologic, immunohistochemical, and ultrastructural study of
nine cases of a distinctive morphologic variant of
myogenic stromal tumor". Am J Surg Pathol 1995;19(1):59-70.
14. Joenssu H, Robert PJ, Sarlomo-Rikaka M et al.
"Brief report effect of the tyrosine kinase inhibitor STI 557 in
a patient with a metastatic gastrointestinal stromal
tumor". N Engl J Med 2001;344:1052-6.
15. Roberts PJ, Eisenberg B. "Clinical presentation
of gastrointestinal stromal tumors and treatment of
operable disease". Eur J Cancer 2002;38:S37-8.
16. Giorgi D.;verweij j.; "Imatinib and gastrointestinal
stromal tumors: where do we go from here?" Mol Cancer
Ther 2005;4(3):495-501.
17. Burton, C.; Azzi, A.; Kerridge, I. "Adverse
effects after imatinib mesylate therapy". N Engl J
Med 2002;346:713.
Endereço para correspondência
ROSALIA MARIKO YOKOYAMA
Rua Elgin, 245, bloco D, ap. 4 Jd. Veneza
Mogi das Cruzes SP
CEP 08715-450
Tel. (11) 9739-3064 e (11) 4726-5981
E-mail: rosalia_taubate@ig.com.br
